2022年是實施“十四五”規劃的關鍵之年,百年變局和世紀疫情交替疊加,國家藥監局認真貫徹習近平總書記有關藥品安全“四個最嚴”要求,以守底線保安全、追高線促發展為基本任務,堅持人民至上、保障用藥安全有效、慎終如始助力保障疫情防控大局,組織各省(區、市)藥品監管部門與相關檢驗機構,在全國范圍內對部分生產、經營、使用等環節的藥品質量開展抽查檢驗工作,評估上市后藥品的質量狀況,打擊制售假劣藥品行為。通過持續完善藥品抽檢管理體系,不斷創新監管的制度機制和方式方法, 協同高效做好新形勢下的藥品抽檢工作。2022年國家藥品抽檢結果顯示,當前我國藥品安全形勢總體平穩可控,藥品質量持續保持在較高水平。
一、概述
藥品抽檢作為藥品監管的重要技術支撐,通過探尋影響藥品質量安全的潛在問題或安全隱患,是發現藥品質量風險、消除藥品質量隱患、持續提升藥品質量的重要手段,是有效打擊假冒偽劣藥品,保障公眾用藥安全的重要舉措。
2022年,為貫徹落實《中華人民共和國藥品管理法》和《中華人民共和國疫苗管理法》,國家藥監局根據《藥品質量抽查檢驗管理辦法》等有關要求,以問題為導向,以風險防控為目標,采取“分散抽樣、集中檢驗、探索研究、綜合評價”的抽檢模式。統籌組織全國31 個省(自治區、直轄市)和新疆生產建設兵團遵循分級抽樣模式抽取樣品;由中國食品藥品檢定研究院等47個承檢機構負責檢驗樣品,構建以問題為導向的藥品質量研究評價體系,揭示可能存在的質量安全隱患,同時完善風險分級防控機制,對發現的問題隨時報告、隨時研判、隨時處置。另外,通過優化藥品抽檢模式,創新“互聯網+監管”的智慧監管手段,如開發啟用“國家藥品抽檢信息系統”APP抽樣模塊,實現手機在線抽樣功能;首次對網絡銷售藥品開展抽樣,探尋線下線上不同來源藥品是否存在質量差異;持續增強中藥材質量監測力度等監管策略,進一步提升抽檢服務監管的效能。
2022年國家藥品抽檢共完成134個品種17060批次制劑產品與中藥飲片的抽檢任務,樣品來源涉及3495家藥品生產、經營企業和使用單位。對檢出的107批次不符合規定產品,國家藥監局組織各省(自治區、直轄市)和新疆生產建設兵團藥品監管部門,對檢出的不符合規定產品及時采取相應的風險控制措施,通過科學分析研判,確定風險點,對涉事企業和單位依法進行查處,對個別企業存在違法違規生產、質量管理水平較低、藥品質量保障體系存在缺陷等問題,依風險等級不同分別開展了有因檢查、風險提示、督促整改等相應的監管措施。通過對不合格產品查控和信息公開、對風險線索核查處置,對藥品從業主體形成了強烈震懾,使其強化了藥品全生命周期和全過程質量控制的意識。
二、抽檢數據分析
(一)抽樣情況
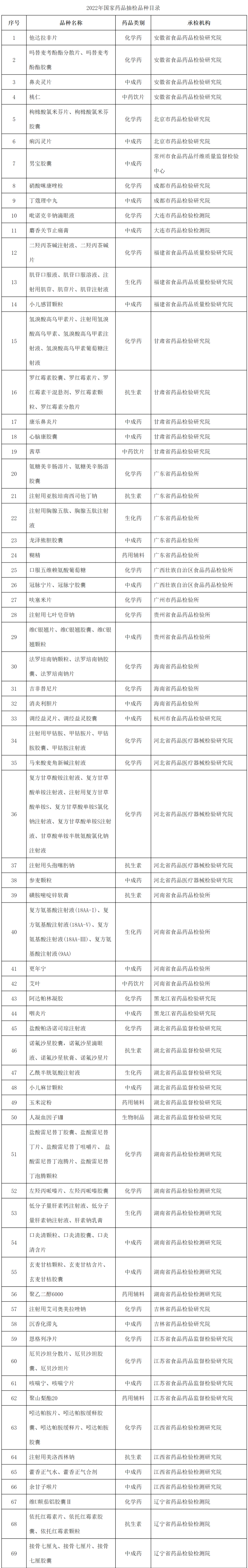
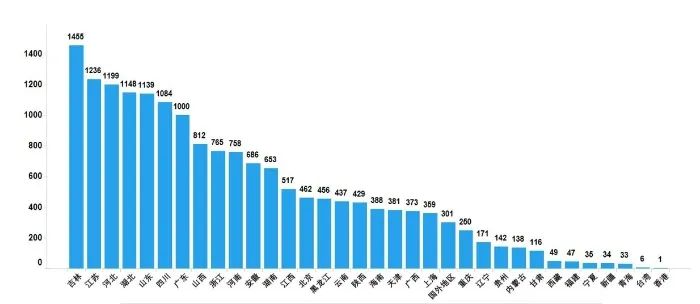
2022年國家藥品抽檢共抽取制劑產品與中藥飲片品種134個,包括化學藥品73個、中成藥47個、中藥飲片9個、生物制品5個,其中國家基本藥物品種47個;共抽檢樣品17060批次,包括生產環節3499批次、經營環節12697批次(其中,互聯網環節51批次)、使用環節864批次(見圖1),涉及977家藥品生產企業、2184家藥品經營企業和334家藥品使用單位,各省(區、市)樣品抽取情況以及所抽取樣品的標示生產企業所在地區抽樣分布情況,分別見圖2與圖3。
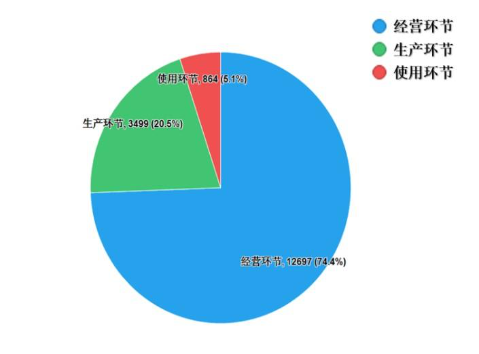
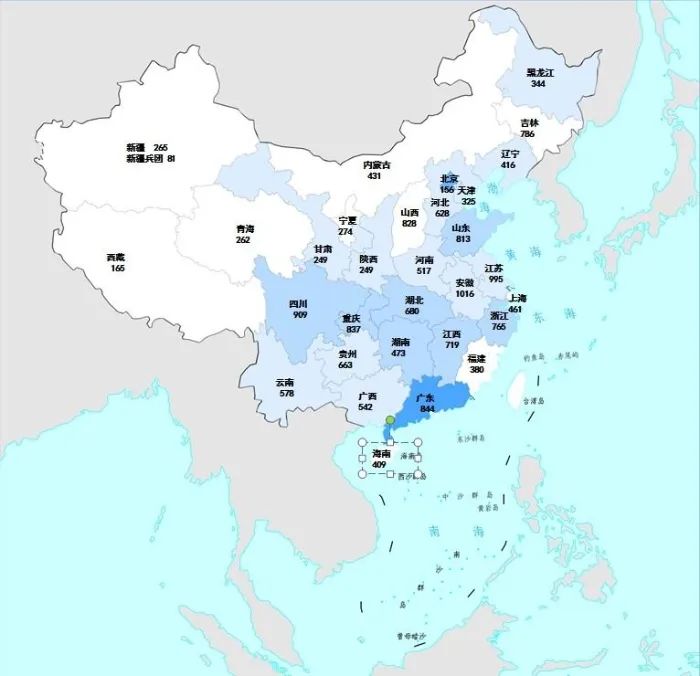
注:圖中數字為各省抽樣批次數,顏色由淺到深分別表示抽樣批次數由低到高。
(二)藥品制劑抽檢數據分析
2022年國家藥品抽檢共抽檢制劑產品15385批次。經檢驗,15332批次產品符合規定,53批次產品不符合規定。抽檢的125個品種中,全部樣品符合規定的制劑品種有108個,共13029批次。其中,化學藥品有68個品種8750批次,中成藥有35個品種4112批次,生物制品有5個品種167批次。
1.化學藥品
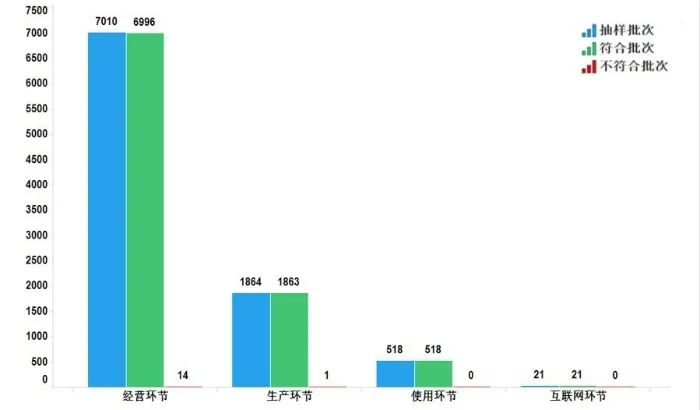
2022年國家藥品抽檢共抽檢化學藥品73個品種(化學藥49個、抗生素14個、生化藥10個)9413批次,涉及生產環節1864批次、經營環節7010批次、使用環節518批次、互聯網環節21批次。經檢驗,共有15批次產品不符合規定,在生產、經營、使用、互聯網環節檢出不符合規定產品1、14、0和0批次,分別占對應環節全部樣品的0.1%、0.2%、0.0%和0.0%(見圖4)。
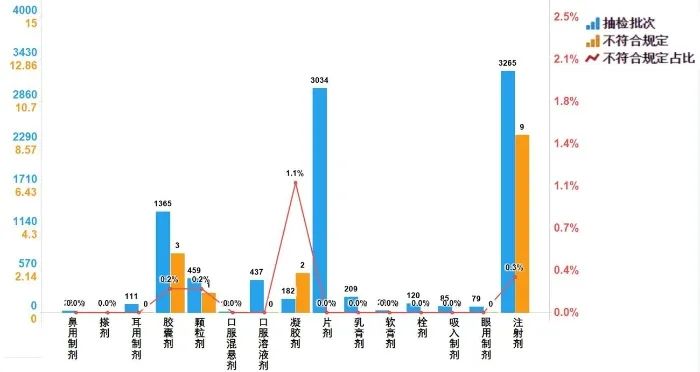
2022年國家藥品抽檢化學藥品共涉及15個劑型,共有4個劑型存在不符合規定產品。其中,注射劑(9批次)、膠囊劑(3批次)、凝膠劑(2批次)、顆粒劑(1批次),分別占對應劑型全部產品的0.3%、0.2%、1.1%和0.2%(見圖5)。
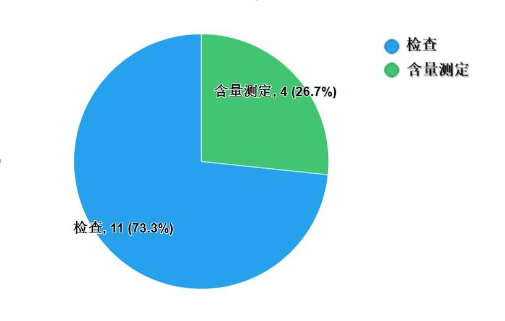
不符合規定項目包括檢查和含量測定,不符合規定產品數量依次為11批次、4批次,分別占全部不符合規定項目的73.3%和26.7%(圖6)。
抽檢結果提示,生產企業應對原輔料和包裝材料進行嚴格把關,優化生產工藝管理與關鍵質量參數控制,重點關注滅菌工藝、原輔料投料量、分裝的穩定性,提高生產工藝穩定性;經營企業應加強藥品儲存、運輸過程管理,提升溫濕度控制水平,重點關注需要陰涼、冷藏儲存等特殊條件保存的藥品;建議監管部門嚴格審查企業批生產記錄,核查原輔料投料量,推動質量標準提升。
2.中成藥
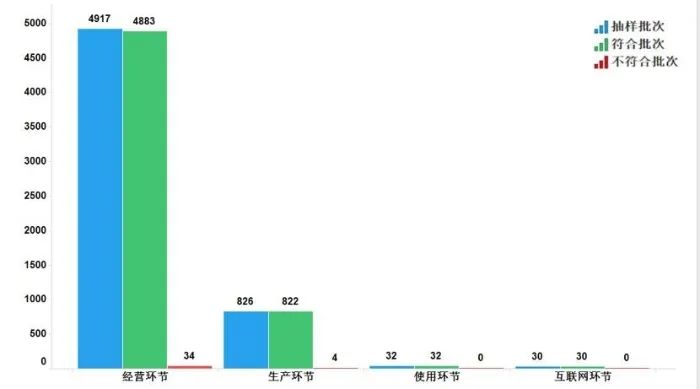
2022年國家藥品抽檢共抽檢中成藥47個品種5805批次,涉及11個劑型,在生產、經營、使用、互聯網環節各抽取樣品826批次、4917批次、32批次、30批次。經檢驗,符合規定5767批次,不符合規定38批次(含4批次補充檢驗檢出高于限量值的灰氈毛忍冬皂苷乙),生產環節和經營環節分別檢出不符合規定產品4批次和34批次,分別占對應環節全部樣品的0.5%和0.7%(見圖7)。
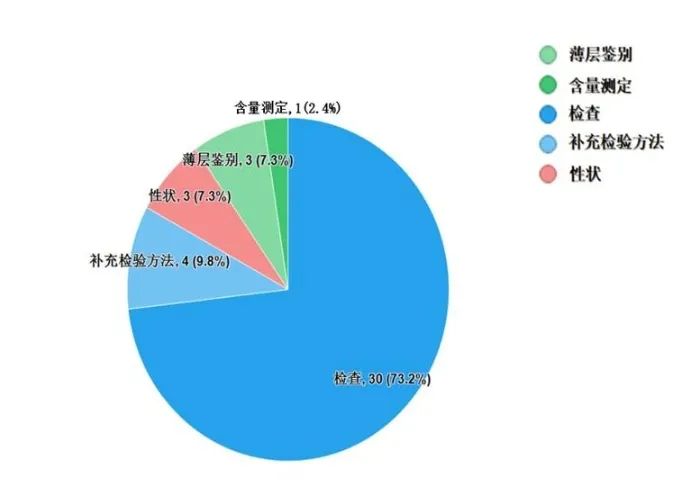
不符合規定項目主要涉及檢查、補充檢驗方法、性狀、鑒別、含量測定項等,不符合規定產品數量依次為30、4、3、3和1批次,分別占全部不符合規定項目的73.2%、9.8%、7.3%、7.3%和2.4%(見圖8)。
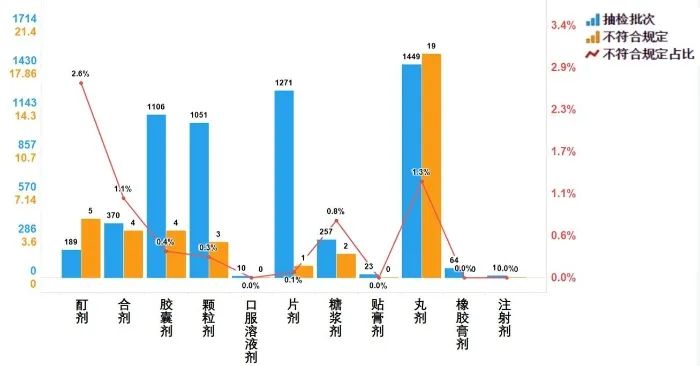
不符合規定產品主要涉及7個劑型,其中丸劑(19批次)、酊劑(5批次)、膠囊劑(4批次)、合劑(4批次)、顆粒劑(3批次)、糖漿劑(2批次)和片劑(1批次),分別占對應劑型全部樣品的1.3%、2.6%、0.4%、1.1%、0.3%、0.8%和0.1%(見圖9)。
抽檢結果提示,生產企業應加強內部質量控制和生產管理水平,從源頭把控藥材質量,嚴格投料藥材入廠檢驗,優化生產關鍵質量參數控制,重點關注產品分裝與滅菌工藝;經營企業應完善藥品運輸、儲存過程管理,避免產品受損;建議監管部門加強對生產企業的監督檢查,督促其嚴格按照處方工藝投料,嚴格執行GMP規范,從而保證中成藥的質量及療效。
注:某些不符合規定產品涉及多個不符合規定項目。
3.生物制品
2022年國家藥品抽檢共抽檢生物制品5個品種167批次,其中生產、經營、使用環節分別抽取52批次、86批次、29批次。其中涉及治療類品種4個,預防類品種1個。劑型均為注射劑(見圖10)。經檢驗,所檢項目均符合規定,合格率為100%。
4. 國家基本藥物
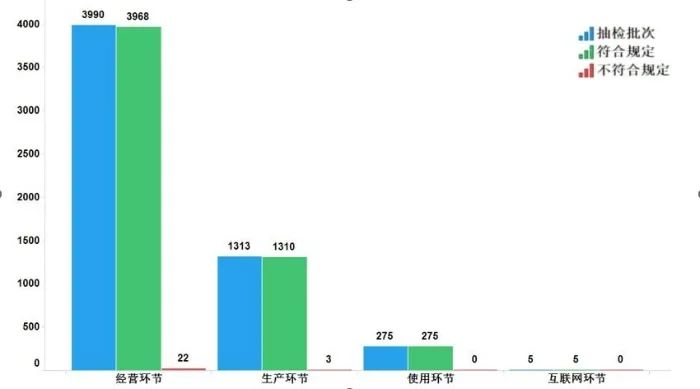
2022年國家藥品抽檢共抽檢基本藥物(不含中藥飲片)38個品種5583批次,在生產、經營、使用、互聯網環節各抽取樣品1313批次、3990批次、275批次、5批次。經檢驗,不符合規定25批次,分別在生產與經營環節檢出不符合規定產品3批次和22批次,涉及4個劑型。抽檢結果顯示,國家基本藥物整體質量狀況較好(見圖11)
5. 國家藥品集中采購中選品種
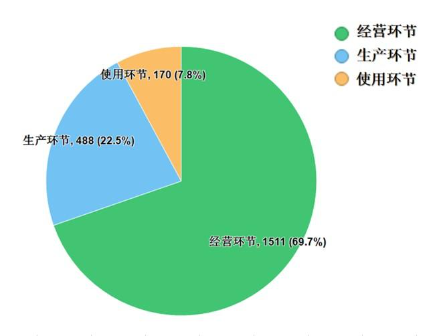
2022年國家藥品抽檢共抽檢藥品集中采購中選品種16個品種2169批次,在生產、經營、使用環節各抽取樣品488批次、1511批次、170批次。經檢驗,所檢項目均符合規定,合格率為100%。抽檢結果顯示,國家藥品集中采購中選品種整體質量狀況較好(見圖12)。
6.進口藥品(不含進口中藥材)
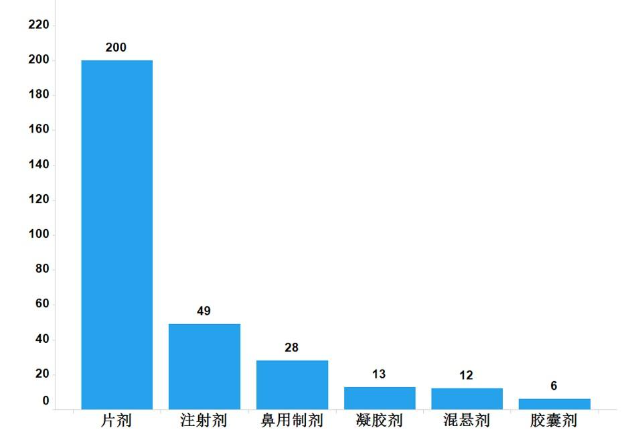
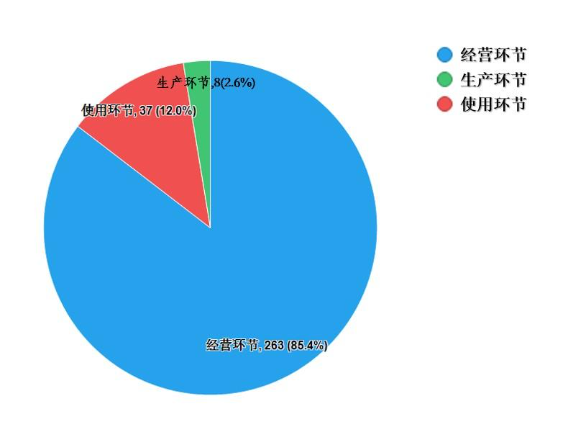
2022年,國家藥品抽檢共抽檢進口藥品308批次,涉及6個劑型(見圖13),其中生產環節8批次、經營環節263批次、使用環節37批次(見圖14)。經檢驗,所檢項目均符合規定,合格率為100%。
(三)中藥飲片專項抽檢及中藥材質量監測情況
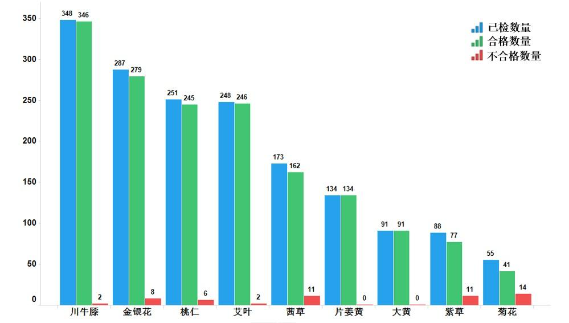
2022年,國家藥監局繼續組織開展中藥飲片專項抽檢。全年共抽檢9個中藥飲片品種1675批次(其中配方顆粒18批,飲片1657批),重點針對可能存在的染色、增重、摻偽或摻假、不規范種植等質量問題,開展檢驗和探索性研究。經檢驗,符合規定1621批次,不符合規定54批次(見圖15)。
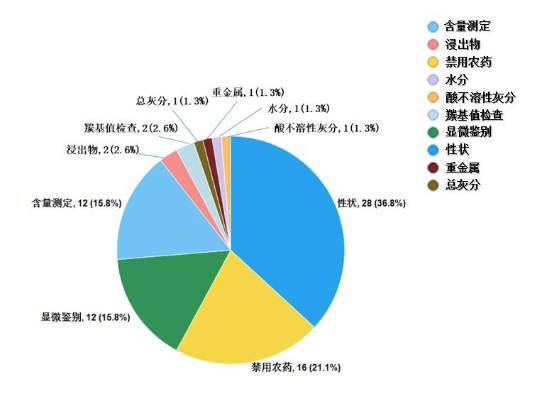
不符合規定項目主要涉及性狀(28批次)、禁用農藥(16批次)、顯微鑒別(12批次)、含量測定(12批次)、羰基值檢查(2批次)、浸出物(2批次)、水分(1批次)、總灰分(1批次)、酸不溶性灰分(1批次)、重金屬(1批次)等方面,分別占全部不符合規定項目的36.8%、21.1%、15.8%、15.8%、2.6%、2.6%、1.3%、1.3%、1.3%、1.3%(見圖16)。
同時,為貫徹落實《中華人民共和國中醫藥法》有關要求,國家藥監局繼續組織開展中藥材質量監測,組織對部分藥品生產企業、藥材市場集散地或種植集中區的中藥材質量進行監測。2022年中藥材質量監測共抽取9個品種241批次樣品,其中,藥品生產企業187批次,市場集散地或種植集中區54批次。所有樣品按照不同品種特點,針對相應項目進行了研究性檢驗,主要針對摻雜摻偽、加工炮制規范、農藥殘留等問題開展。
2022年中藥飲片專項抽檢及中藥材質量監測發現的主要問題有:一是混偽品摻偽問題,如片姜黃存在蓬莪術摻偽、山銀花摻偽金銀花、麻牛膝摻偽川牛膝、紫草飲片存在同屬與近源屬植物混用問題;二是摻雜問題,如茜草中摻入較多地上莖導致性狀、顯微鑒別、浸出物不符合規定;三是外源性有害物質殘留超限問題,部分飲片存在農藥殘留、重金屬及有害元素超標等隱患,如部分批次菊花禁用農藥超標、個別批次金銀花重金屬超標、部分批次川牛膝重金屬超出通則限量規定、檢出植物生長調節劑;四是采收加工與加工炮制不規范問題,如不同采收期金銀花樣品質量差異較大、川牛膝干燥過程中未按藥典規定進行發汗,且存在產地趁鮮加工現象。
抽檢及監測結果提示,我國中藥材及飲片總體質量狀況良好。但中藥飲片全產業鏈參與者應進一步提高質量意識和責任意識,中藥飲片生產企業應提升全程質量控制意識,嚴格遵照質量標準及炮制規范要求執行;從源頭保障原料藥材的質量,重視中藥材的道地性種植及規范生產,對藥材采收后、飲片炮制加工前的藥材供貨商環節的質量把控,重點關注摻偽、有害物質殘留等問題;加強藥材溯源管理及貯存環節管理,督促藥品上市許可持有人嚴格工藝規程與購進藥材質量控制;繼續強化中藥材市場監測。
注:某些不符合規定產品涉及多個不符合規定項目。
(四)探索性研究
探索性研究在識別摻雜使假、打擊違法違規生產、提升國家藥品標準等方面發揮了重要作用,也為推動企業藥品質量后續技術研究提供了更加專屬的方法和參考。2022年,各藥品檢驗機構按照法定藥品標準方法與探索性研究方法檢驗并重原則,全面考察藥品的安全性、有效性、現行標準的可行性,同時探尋潛在風險,為提升藥品質量標準、提高監督管理水平提供科學可靠的技術依據。發現的主要問題有:
一是中藥飲片混用摻偽問題,使用偽品、摻偽的中藥材及飲片生產中藥制劑的問題仍然存在;二是個別企業違法違規生產問題仍然存在,如擅自改變生產工藝,低限或使用摻偽、替代品投料,違反關鍵工藝制法,擅自改變或添加輔料、防腐劑和抑菌劑等;三是不同廠家使用的原料藥質量存在差異,部分制劑的質量差異值得進一步研究比較;四是外源性有害物質超限,部分品種重金屬、農藥、防腐劑殘留量超限;五是包裝材料相容性問題影響產品質量穩定性。
三、抽檢結果應用
藥品抽檢作為藥品監管的重要手段,在發現藥品質量風險、打擊違法違規行為中發揮著不可替代的重要作用,是實現科學監管、嚴格監管的重要技術支撐。國家藥品抽檢的目的不僅僅是把控風險、規范生產和保障藥品質量安全,其成果的積極運用更是持續提升藥品質量,推動產業提質升級的重要途徑。
(一)創新抽檢模式,探索智慧監管。
為了不斷推進藥品抽檢制度體系現代化,健全完善藥品抽檢模式,2022年運用“互聯網+監管”的智慧監管手段,優化創新抽樣模式,如啟用“國家藥品抽檢信息系統”抽樣APP抽樣功能,實現手機錄入操作,抽樣APP進一步優化了在線抽樣功能,發揮抽檢工作數字化優勢,一定程度上解決了抽樣人員攜帶抽樣設備、抽樣單位公章等過于繁瑣的問題;通過首次對網絡銷售藥品開展抽樣的模式,旨在探尋線下線上不同來源藥品是否存在質量差異;關注歷年風險品種,通過持續增強中藥材質量監測力度等監管策略,進一步提升抽檢服務監管的效能。
(二)聚焦社會熱點,開展專項監測。
近年來,藥品安全突發事件是公眾和媒體關注的焦點,隨著檢測分析技術的日新月異,一些已上市成熟藥品中未曾被暴露的質量安全性問題被逐漸揭示。例如,國家藥監局聚焦社會熱點和監管中出現的新問題,針對個別化學藥品中可能含有基因毒性雜質的潛在風險,2022年繼續設立研究專項,對雷尼替丁等5個品種開展專項抽檢,并持續加強同類型或相似潛在風險的監測和隱患排查,對相關科學問題開展深度研究,對發現的超限產品及時采取召回等控制措施,并要求將其納入地方藥品抽檢開展跟蹤抽檢,確保整改到位。多年來,監管部門、技術機構、持有人等各方依職責采取建立方法、自查自檢、技術指導、監督抽檢、風險控制等措施,化學藥品中基因毒性雜質問題得到有效控制。
(三)深入排查風險,查控假劣藥品。
2022年,國家藥監局依照“風險控制-依法處置-排查原因并整改-信息公開”的監管模式,確保風險關閉、警示用藥安全。組織各省級藥品監管部門對國家藥品抽檢發現的107批次不符合規定產品,在第一時間采取了查封扣押、暫停銷售使用、要求企業主動召回等風險控制措施;對涉及的相關企業和單位均依法組織查處;同時要求藥品生產企業認真排查,督促其查找問題原因并切實整改,確保質量安全隱患得到及時有效清除。通過藥品抽檢嚴厲打擊了制售假劣藥品的行為,發揮了震懾不法企業、凈化市場環境的作用。此外,國家藥監局在2022年共發布藥品補充檢驗方法5個,為打擊隱蔽性極強的摻雜摻假等違法行為提供了監管利器,也為企業提供了保障藥品質量安全的科學依據。
(四)加大風險提示,落實主體責任。
對探索性研究中發現的有關生產工藝、處方、原輔料、包裝材料、說明書等方面可能存在的一般性問題,藥品監督管理部門通過“藥品質量提示函”等形式反饋相關企業,提升企業的質量意識,加強企業主體責任的落實。
例如,通過探索性研究,發現部分批次布地奈德吸入氣霧劑采用乙醇為溶劑的溶液體系存在包材相容性問題,且抗氧劑消耗過快無法在有效期內持續發揮抗氧化作用,提示其處方設計存在缺陷;小兒感冒顆粒探索性研究發現,部分批次石膏中鈣含量遠低于擬定的限度值,石膏顯微特征難見,提示生產企業未按照制劑工藝進行原粉投料。企業就風險提示開展排查、分析和驗證,采取優化生產工藝、提高內控標準、加強原輔包質量控制等整改措施,提升產品質量水平。
(五)深化信息公開,構建共治格局。
國家藥監局繼續以通告的形式,依法及時向公眾警示不符合規定藥品抽檢信息,筑牢公眾用藥安全防線,2022年共發布藥品質量通告6期,同時也震懾不法企業,提升藥品監管權威性,提高政府公信力。中檢院持續在官方網站公開國家藥品抽檢的探索性研究情況,2022年共發布159個品種的新建檢驗方法、通過信息的共享利用,進一步促進上市持有人的質量安全意識和主體責任自律意識,促進產品研發創新升級。
2022年12月,“藥品質量安全年會” 作為行業內獲取藥品質量提升信息的重要渠道之一,以線上形式舉辦,通過搭建檢驗檢測生產研發機構信息交流平臺,通報藥品抽檢結果、分析藥品質量狀況,挖掘質量安全問題,助推藥品產業發展提質升級,全面構建政府監管、行業自律、企業自治、社會監督的質量共治格局。
四、結語
2022年國家藥品抽檢工作順利完成。檢驗及研究結果顯示,我國藥品質量仍處于較高水平,整體安全形勢穩中向好。
2023年是全面貫徹落實黨的二十大精神的開局之年,國家藥監局將認真落實習近平總書記關于藥品監管工作的重要指示批示精神,自覺把藥品監管工作放到以中國式現代化推進中華民族偉大復興的宏大場景中去謀劃,堅持問題導向,聚焦重點任務,完善運行機制,創新監管方式,扎實推進中國式藥品監管現代化,持續筑牢藥品安全底線,提升藥品監管效能,奮力譜寫全面建設社會主義國家的藥監新篇章。
小貼士
1.藥品抽檢歷史沿革
1956年,我國首次提出藥品計劃抽檢的概念;1964年,原衛生部第一次制定國家級年度藥品抽檢計劃并組織實施;1984年頒布《中華人民共和國藥品管理法》,第一次從法律上明確了藥品抽檢工作的地位;1986年,實行藥品質量公報制度;1990年,實行藥品抽檢收費制度,即抽檢藥品須由被抽檢單位付檢驗費;2001年,《中華人民共和國藥品管理法》修訂,取消了藥品抽檢收費制度,所需費用由財政列支;2019年,《中華人民共和國藥品管理法》再次修訂,明確“藥品監督管理部門根據監督管理的需要,可以對藥品質量進行抽查檢驗”、“抽樣應當購買樣品”。
2.藥品標準檢驗
藥品標準檢驗是指具有檢驗資質的藥品檢驗機構,依據國家藥品監督管理部門批準的法定檢驗標準中的檢驗方法,進行全項目或部分項目的檢驗,并依法出具檢驗報告書的過程。
3.探索性研究
探索性研究是指在國家藥品抽檢過程中,除按照國家藥品標準進行檢驗并判定藥品是否符合標準規定之外,針對可能存在的質量問題,應用該品種國家藥品標準以外的檢驗項目和檢測方法對藥品質量進行進一步分析研究的過程。探索性研究結果不作為判定藥品合格與否的依據,可為進一步提升藥品質量水平、加強藥品監管提供技術支持。
4.國家基本藥物
國家基本藥物是適應基本醫療衛生需求,劑型適宜,價格合理,能夠保障供應,公眾可公平獲得的藥品。國家基本藥物目錄是各級醫療衛生機構配備使用藥品的依據。《國家基本藥物目錄(2018年版)》中的藥品包括化學藥品和生物制品、中成藥、中藥飲片3部分,其中,化學藥品和生物制品主要依據臨床藥理學分類,共 417個品種;中成藥主要依據功能分類,共268個品種;中藥飲片不列具體品種,頒布國家標準的中藥飲片為國家基本藥物,國家另有規定的除外。
5.藥品補充檢驗方法
藥品補充檢驗方法和檢驗項目(藥品補充檢驗方法)適用于有摻雜、摻假嫌疑,且國家藥品標準規定的檢驗方法和檢驗項目不能檢驗的藥品檢驗。經國務院藥品監督管理部門批準后,使用補充檢驗方法和檢驗項目所得出的檢驗結果,可以作為藥品監督管理部門認定藥品質量的依據。
6.檢驗項目
性狀項下記載藥品的外觀、臭、味、溶解度以及物理常數等,在一定程度上反映藥品的質量特性。
鑒別項下規定的試驗方法,系根據反映該藥品的某些物理、化學或生物學等特性所進行的藥物鑒別試驗,不完全代表對該藥品化學結構的確認。
檢查項下包括反映藥品的安全性與有效性的試驗方法和限度、均一性與純度等制備工藝要求等內容;對于規定中的各種雜質檢查項目,系指該藥品在按既定工藝進行生產和正常貯藏過程中可能含有或產生并需控制的雜質(如殘留溶劑、有關物質等);改變生產工藝時需另考慮增修訂有關項目。
含量測定項下規定的試驗方法,用于測定原料及制劑中有效成分的含量,一般可采用化學、儀器或生物測定方法。
附表